Fundamento teorico
El cobre ,la plata y el oro son metales que se emplearón desde épocas muy antiguas en la fabricación de objetos ornamentales asií como monedas ,por lo que se les conoce como”metales de acuñar”.Los tres se encuentran al estado libre en la naturaleza y se obtienen en forma simple por reducción de sus compuestos .El cobre fue uno de los primeros metales que se moldeo para la fabricación de instrumentos , ya que se han hallado utensilios y armas de cobre fabricadas en la edad de piedra. Asimismo se han encontrado ornamentos de oro en tumbas preincaicas y egipcias de la edad de piedra acuñadas por antiquisimas civilazaciones .
El nombre de metales nobles con que también se les conoce a estos metales se debe a su baja electropositividad , que impide que sean fácilmente oxidados ,lo que lesda gran resistencia a la corrosión .Por esta razón solo pueden ser diluidos por ácidos fuertes concentrados (ácido nítrico y ácido sulfurico caliente).
El cobre es un metal rojizo ,muy dúctil y maleable .lo que permite transformarlo en a lambres ,cables , láminas y tubos .Al estado puro el cobre es uno de los mejores conductores del calor y de la electricidad .
Hablando de lixiviación de cobre,podemos decir que existen tres tipos de lixiviación :
I. Lixiviación en DUMP .-Sulfuros y óxidos de baja ley de operaciones a cielo abierto a gran escala .Puede durar varios años .La operación se realiza sin chancar .
II. Lixiviación en Heap .-Mineral oxidado poroso .El ciclo de tratamiento puede durar unos meses Puede estar chancado o sin chancar .
III. Lixiviación VAT .-Mineral oxidado de cobre chancado.El ciclo de tratamiento dura unos días. Todo esto nos da una visión clara , de cuanto mayor es la superficie de tratamiento del mineral,mayor velocidad con respecto al tiempo será su lixiviación .Recientemente , la lixivación insitu de depósitos de menas ha recibio un enfásis especial y parece ser un área en la cual seran hechos significantes avances en un futuro cercano.Este tipo de operación hidrometalurgica es frecuentemente referida como solución de mina ,Es muy importante considerar la lixiviación en DUMP como parte de la solución de mina desde que las propiedades físicas y químicas son similares a la lixiviación de depósitos fragmentados en el lugar .Mucho de lo que se espera de la extracción insitú puede ser derivado de la experiencia corriente y práctica en lixiviación en DUMP. Virtualmente todos los investigadores estan de acuerdo que la lixiviación de fragmentos de menas comprende la penetración de la solución en la estructura de la mina porosa.La cinética comprende difusión de lixiviante en la rica donde la reacción ocurre con partículas de minerales individuales ,la cinética es complicada por el cambio de porosidad ,pH y concentración de soluciones.
Preparacion y Estandarización de soluciones
1.1.-Preparación –Procedimiento
NaOH
Vsol=0.15 L
Conc= 0.8 N
W=0.8 * 40 * 0.15/1 W= 4.8 gr NaOH
Disolvemos 4.8 gr de NaOH en agua hasta 150 ml.
HCL
Vsol = 1.0 L
Conc1= 0.1 N
Conc2=13 N
V1*N1=V2*N2
V2=(1*0.1/13)*1000
V2=7.69 ml
Diluimos los 7.69 ml de HCL concentrado hasta 1.0 L
Na2CO3
Vsol=1.0 L
Conc=0.1 N
[N]=Eq-gr/v [N]=(W*O)/(M*V)
W=N*M*V/O W=0.1*106*1.0/2.0
W= 5.3 gr de Na2CO3
Disolvemos los 5.3 gr de Na2CO3 hasta 1.0 L
Biftalato de Potasio
Vsol=25 ml
W= 0.5 gr
[N]=W*O/M*W N=(0.5 * 1.0 )/(204.216*0.25)=0.0979
Disolvemos 0.5 gr de Biftalato de potasio hasta 25 ml .
Titulaciones
a)NaOH con Biftalato de Potasio
N1*V1=N2*V2
O tambien por la fórmula=Peso Biftalato*1000/204.216*Vgastado
De esta ecuación se puede despejar el valor de N1
NaOH (1) Biftalato de potasio (2)
Volumen (ml) 3.5(gastado) 25.0
Normalidad 0.699 0.0979
b)HCL con NaOH
Indicador:Fenolftaleína
Viraje : De incoloro a rojo
HCL(1) NaOH (2)
Volumen (ml) 4 ml 0.4 (gastado)
Normalidad 0.07 0.7
c)Na2CO3 con HCL
Indicador:Fenolftaleína
Viraje:Incoloro a rojo.
Na2CO3(1) HCL(2)
Volumen(ml) 12.7(gastado) 10
Normalidad 0.055 0.07
d)H2SO4 con Na2CO3
Indicador:Rojo de Metilo
Viraje: Rojo a Amarillo
H2SO4 (1) Na2CO3(2)
Volumen(ml) 2.0 12.8(gastado)
Normalidad 0.384 0.06
Se sabe lo siguiente :
W/V=N*M/O [H2SO4]=18.882 gr / L
II.Condiciones –Calculos-Procedimiento
II.1.- Condiciones del Proceso
Relación Solido/Líquido :=1/3
Volumen de Damajuana =1330 ml/4
Volumen de mineral + agua= 332.5 ml
Volumen de Ac.Sulfurico=1330-335ml
V H2SO4=997.5 ml
Wprobeta=128.4 gr Wprobeta + Mineral =162,3 gr
W mineral= 33.9 Volumen de mineral en probreta= 20 ml
Densidad= 33.9 / 20
Densidad (mineral en seco)=1.7 gr/cc
Wmin=Densidad * V
Wmin=1.7 * 332.5
Wmin= 565.25 gr
Luego calculamos el volumen de Acido:
H2SO4 ....25 gr/lt
(25 gr/1000ml)*997.5 ml =24.93 gr
Densidad de H2SO4=1.84
WH2SO4= 24.93/1.84=13.58 ml
Temperatura= Ambiente
II.2-Procedimiento
Lo que haremos es una lixiviación de mineral de cobre diluido en ácido Sulfúrico .La solución se vierte en una botella y mediante agitación mecánica de la misma en posición horizontal se procede a lixiviar el mineral .A intervalos de 10 m se saca muestras de 5ml procediendo a centrifugar .La solución verdosa rica en iones de Cu+2 ,se separa del sólido centrifugado que inmediatamente vuelve a la botella para nuevamente hacer otro análisis identico al anterior .El pH debe mantenerse apróximadamente constante en todo momento.
La Reaccion Del Proceso
Cu+2 + H2SO4 = CuSO4 + H+
V=1 ml
Muestra Tiempo (min) pH v,t(ml) Normalidad [Cu+2] % Cu
1 10 5.2 2.5 0.25 7.94 42.19
2 20 5.4 3.8 0.38 12.07 64.13
3 30 5.5 2.7 0.27 8.58 45.59
4 40 5.6 2.5 0.25 7.94 42.19
5 50 5.9 2.4 0.24 7.62 40.49
6 60 6.0 2.3 0.23 7.31 38.84
7 70 6.1 2.3 0.23 7.31 38.84
8 80 6.2 2.1 0.21 6.67 35.44
9 90 6.2 2.1 0.21 6.67 35.44
10 100 6.2 2.0 0.20 6.35 33.74
11 110 6.3 2.0 0.20 6.35 33.74
7.94 = 0.25 * 63.54 /2
III.Calculo Del Orden De La Reaccion
Se sabe que la velocidad de reacción química “V” es:
A + B = C + D
Cu+2 + H2SO4 = CuSO4 + 2H+
n
V=OC/Ot =K*C
Donde:
V=velocidad de reacción
C=Concentración
T= Tiempo
K=Constante de Velocidad
N=Orden de La Reacción
Aplicando logaritmo neperiano a la ecuación anterior ,obtendremos una ecuación que se asemeja a una ecuación de segundo grado a la cual se le calculara su intercepto con el eje Y y su pendiente m.
Ln( C/ t) =log K + nLog C
Según la gráfica de regresión lineal calculada se han obtenido los datos de
m=pendiente= 1.0216 como m= n
Por lo tanto el orden de la reacción es de n=1.0216
b = 0.1894 Log K =-0.1894 de donde : K=0.6465
Podemos hallar la Velocidad de Reacción:
n
V=( valor de K) *C
Luego :
n
V= 0.6465 * C
La finalidad de la práctica ,desde el punto de vista metalúrgico ,es determinar el tiempo de lixiviación del mineral para obtener la máxima recuperación y comparando con el volumen de reactivo utilizado averiguar si el método aplicado a la especie mineralógica es rentable o no.
Analisis cuantitativo del Cu
Solución Titulante
Tiosulfato de Sodio 0.1 N Na2S203.5H2O
Preparación :
Pesar 25 gr de tiosulfato de Na .Disolver en agua recientemente hervida y fría.
Agregar 0.11 gr de Na2CO3 y completar a 1L con agua hervida y fría .
Esta solución se estandariza vs cobre electrolitico.Se pesa 100 gr de Cu electrolítico y se debe gastar apróximadamente 16 ml de tiosulfato.
Solucion de Almidon.-2.4 gr de almidon se le agrega 7 ml de H2O destilada y se forma una pasta ,lentamente se agrega 500 ml de agua destilada hirviendo se agita se enfra y se agrega 4 grs de IK,completando el volumen a 2000ml (colocar en botella oscura).
ESTANDARIZACION DEL TIOSULFATO DE SODIO vs Cu ELECTROLITICO
Pesar 100 mg de Cu electrolítico ,poner en un enlemeyer de 125 ml y adicionar 5 ml de HNO3 concentrado y llevar asequedad ,diluir con 50 ml de aagua destilada y enfriar la solución .Añadir un gramo de yoduro de potasio KI agitar para disolver la solución y titular con la solución de Tiosulfato de Sodio 0.1 N hasta una coloración amarilla .
Agregar 2ml de la solución de almidon al 1% y continuar la valoración hasta que el color azul desaparezca completamente tomando la solución un color blanco lechoso .Anotar el gasto.
Factor=Peso Cu (gr)electrólitico /vol Na2S2O3.H2O gastado
Si la solución esta bien hecha ,100 mg de Cu electrolítico gastará 16 ml de Tiosulfato de Sodio 0.1 N
Por lo tanto el factor será:
F=0.100/16= 0.00625 gr de Cu/ ml de titulante
El porcentaje de Cu presente en una muestra se determina por :
%Cu= Gasto Na2S2O3*F*100/Pesomuestra
Para la muestra
La muestra procedente de la lixiviación se mide exactamente el volumen .
Se coloca en un enlenmeyer de 250 ml ,se le lleva a sequedad en una plancha ,se retira de la plancha y se diluye hasta 50 ml con H2O destilada .Agregar 2 ml de H3PO4 concentrado ,la solución fría se titula con Tiosulfato de Sodio previamente preparado .
Analisis Cuantitativo del Cobre
Muestra Peso Volumen Gastado % Cu
(ml)
1 2.7 9.8 2.268
2 2.2 7.5 2.130
3 2.2 7.4 2.102
4 2.3 7.1 1.929
5 2.7 8.8 2.037
6 2.4 7.9 2.057
7 3.7 12.5 2.111
8 3.8 12.8 2.162
9 3.8 12.9 2.121
10 3.5 11.8 2.107
martes, 30 de diciembre de 2008
Lixiviación de oro
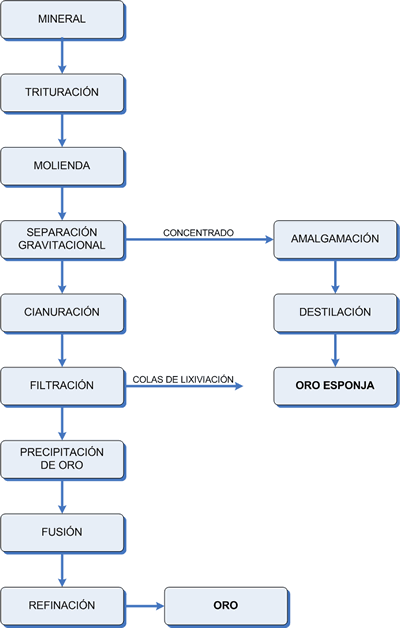
El tratamiento metalúrgico de las menas de oro esta basado principalmente en las propiedades inusuales del oro nativo y sus posibles aleaciones con plata (electrum). Esto es por su alto peso específico comparado con los de la ganga asociada y por otro lado por su solubilidad en soluciones alcalinas diluidas de cianuro de sodio o potasio. La separación gravitacional y la cianuración de menas trituradas o molidas constituyen los métodos más comunes que se ve en el siguiente diagrama de flujo. 750) this.width=750" border=0> Concentración gravitacional Es él termino generalmente usado para describir aquellas operaciones donde mezclas de partículas de distintos tamaños, forma y pesos específicos, son separadas unas de otras por medio de la fuerza centrifuga. Su principio se basa en los efectos del peso específico sobre el asentamiento diferencial de las partículas en un fluido. Es un hecho que las partículas livianas y planas se depositan lentamente y las partículas pesadas y esféricas caen más rápidamente. El fundamento del proceso gravitacional es la diferencia del Peso específico entre los diferentes minerales a separar. La molienda de las menas debe ser lo suficientemente fina como para liberar los minerales valiosos de la ganga. Si partes de la ganga están unidas aun a partículas de mineral valioso, disminuye el peso específico de la partícula y con esto la efectividad de los métodos de clasificación. El desarrollo tecnológico en maquinarias que aplican este principio es incesante. Podríamos hacer una pequeña reseña sobre algunos de estos equipamientos: Concentrador en espiral. Espiral de Humphrey El principio del espiral esta basado en el principio de concentración a través de un flujo laminar, en el hecho que una partícula se desliza en un canal circular a través de una corriente de fluido (agua), esta sujeta por lo menos a cuatro fuerzas a saber: Fuerza gravitacional Fuerza centrifuga Empuje del líquido Roce contra el fondo del canal Cuando la pulpa corre hacia abajo por el canal en espiral de sección semi circular cada partícula esta sujeta a la fuerza a la fuerza centrifuga tangencial al cause. Esta fuerza es directamente proporcional al radio en donde esta ubicada la partícula. La fuerza centrifuga empuja al liquido hacia la periferia de la espiral hasta que la corriente de la pulpa alcanza el equilibrio entre la fuerza centrifuga y la de gravedad. En tal caso la velocidad del flujo a través de la espiral decrece con la profundidad, siendo máxima en la superficie del líquido y tendiendo a cero hacia el fondo. Esta disminución proporcional de la aceleración es mayor en la cercanía del contacto pulpa - superficie del canal, formando sobre el una película de fluido retardado por el roce. Dicho efecto hace disminuir la fuerza centrifuga y las partículas decantadas en el fondo son llevadas hacia el interior del canal, mientras que las más livianas son arrastradas hacia la superficie. En resumen, la fuerza resultante que lleva la partícula pesada hacia el interior del canal es la resultante de las cuatro fuerzas nombradas con anterioridad. Variables operativas: * Alimentación sobre 8 toneladas por hora de sólido. * Porcentaje de sólido en la pulpa aproximadamente el 60% en peso. * Granulometría de alimentación desde 0,003 mm a 2 mm. * Volumen máximo de pulpa cercano a 5 m3/hora. Jigs (vibración o flotación) Es un tipo de concentrador gravitacional mecánico, en donde una cama de partículas (de diferentes tamaños, formas y densidades específicas) es fluidizada por un chorro de agua intermitente (en dirección vertical). Este proceso aprovecha la velocidad de caída de los sólidos, las partículas mas pesadas caen más rápido y logran recorren mayores distancias que las más livianas. Al subir el fluido da un impulso a las partículas, donde las más livianas alcanzan mayores alturas (menor inercia). Después de repetidos impulsos se forma una camada de partículas ordenadas según su densidad. Las más densas se ubican el fondo y las más livianas en la superficie. Lo esencial en el funcionamiento de este equipo es la estratificación de partículas según sus densidades. Pueden considerarse tres factores que contribuyen a la estratificación, ellos son: 1. Clasificación por caída contrariada. 2. Diferencia de aceleración. 3. Consolidación de los estratos (compactación de la cama de mineral). Cianuración La cianuración es un proceso que se aplica al tratamiento de las menas de oro, desde hace muchos años. Se basa en que el oro nativo, plata o distintas aleaciones entre estos, son solubles en soluciones cianuradas alcalinas diluidas, regidas por la siguiente ecuación: 4 Au + 8 CNNa + O2 + 2 H2O → 4 (CN)2 Na Au + 4 HONa Esta formula es conocida como la ecuación de ELSNER. Las principales variantes de lixiviación son: 1. La lixiviación por agitación. 2. La lixiviación por percolación. Lixiviación por agitación La mena molida a tamaños menores a las 150 mallas (aproximadamente tamaños menores a los 105 micrones), es agitada con solución cianurada por tiempos que van desde las 6 hasta las 72 horas. La concentración de la solución cianurada esta en el rango de 200 a 800 ppm (partes por millón equivale a gr de cianuro por metro cubico de solución). El pH debe ser alto, entre 10 y 11, para evitar la perdida de cianuro por hidrólisis (generación de gas cianhídrico, CNH, altamente venenoso) y para neutralizar los componentes ácidos de la mena. Para evitarlo anterior se usa cal, para mantener el pH alcalino. Se adiciona lo necesario para mantener la concentración de Oca libre en la solución por encima 100 gr/m3. La velocidad de disolución del oro nativo depende entre otros factores, del tamaño de la partícula, grado de liberación, contenido de plata. Es la práctica común, remover el oro grueso (partículas de tamaño mayores a 150 mallas o 0,105 mm), tanto como sea posible, mediante concentración gravitacional antes de la cianuración, de manera de evitar la segregación y perdida del mismo en varias partes del circuito. Es de suma importancia, aparte de determinar la naturaleza de los minerales de oro, poder identificar la mineralogía de la ganga, ya que esta puede determinar la efectividad o no de la cianuración. Esto por que algunos minerales de la ganga pueden reaccionar con el cianuro o con él oxigeno, restando de esa manera la presencia de reactivos necesarios para llevar adelante la solubilización del oro. Se realizan ensayos a escala laboratorio, con el objeto de determinar las condiciones optimas para el tratamiento económico y eficiente de la mena. Las variables a determinar son las siguientes: 1. Consumo de cianuro por tonelada de mineral tratado. 2. Consumo de cal por tonelada de mineral tratado. 3. Optimo grado de molienda. 4. Tiempo de contacto, ya sea en la lixiviación por agitación como en la lixiviación por percolación. 5. Concentración más conveniente del cianuro en la solución. 6. Dilución más adecuada de la pulpa. Lixiviación por percolación Lixiviación en pilas La cianuración en pilas es un método que ya sé esta aplicando con regularidad en varios yacimientos a nivel mundial, para procesar minerales de oro y plata de baja ley, se aplica también en yacimientos del tipo hidrotermal en la zona oxidada, es decir vetas de alta pero de volumen pequeño, generalmente explotados por la pequeña minería. La cianuración en pilas es una lixiviación por percolación del mineral acopiado sobre una superficie preparada para colectar las soluciones Este método es bastante antiguo y se lo utilizaba para lixiviar minerales de cobre y uranio. Si bien este método fue concebido para explotar grandes depósitos de oro de baja ley, se lo usa también para depósitos de pequeño volumen y de alta ley, debido a sus bajos costos de capital y operación. Su flexibilidad operativa permite abarcar tratamientos que pueden durar semanas, meses y hasta años dependiendo del tamaño del mineral con que sé este trabajando. El mineral fracturado se coloca sobre un piso impermeable formando una pila de una cierta altura sobre la que se esparce una solución de cianuro diluida, la que percola a través del lecho disolviendo los metales preciosos finamente diseminados en la mena. La solución enriquecida de oro y plata se colecta sobre el piso impermeable, dispuesto en forma ligeramente inclinada que hace que fluya hacia la pileta de almacenamiento, desde ahí se alimenta el circuito de recuperación. Este circuito de recuperación de oro y plata, desde las soluciones cianuradas diluidas las que contienen los metales nobles en solución, puede ser de dos tipos preferentemente, a saber: * Precipitación con Carbón activado * Cementación de oro con Zinc Precipitación con Carbón activado y cementación de oro con Zinc Precipitación con Carbón activado Los carbones activados se utilizan por su estructura granular, los que tienen una gran superficie especifica, las que permiten un alto grado de adsorción del oro y la plata, desde las soluciones cianuradas ricas a la superficie de estos carbones. A nivel industrial el método de adsorción por carbón activado es él más usado. El carbón activado se fabrica a partir de la corteza del coco debido a su dureza lo que lo hace más resistente a la abrasión y la rotura, adema su capacidad de adsorción es mayor que otros carbones activados fabricados a partir de otros materiales. En estas operaciones se hacen pasar las soluciones que percolan de las pilas de lixiviación, por 5 o 6 columnas, las que en su interior contienen el carbón activado. Las columnas en contacto con las soluciones cianuradas son periódicamente rotadas para tener un mayor aprovechamiento de la capacidad de adsorción del carbón. La alimentación de las columnas se hace en contracorriente las que mantienen las partículas de carbón en suspensión evitando que el lecho se compacte La cantidad de oro que puede cargar un carbón activado depende de la cantidad de cianuro libre que haya en la solución, las impurezas y del pH de la solución, como así también del tiempo de contacto o dicho de otra forma del flujo de alimentación. La primera columna que se contacta con la solución es retirada periódicamente y rotadas las restantes, agregándose al final una nueva columna con carbón descargado. El oro adsorbido sobre el carbón activado es extraído del mismo, mediante una solución alcalina de sulfato de sodio o bien una solución cianurada en caliente. El oro que contendrá esta ultima solución cianurada, se puede recuperar mediante electrólisis y luego purificarlo (refinado). Al carbón descargado, se le realiza un proceso de reactivación, el que consiste en eliminar los carbonatos y sílice presente, mediante el lavado con solución de ácido nítrico diluido en caliente y soda cáustica, para luego someterlo a una etapa de reactivación en un horno elevando su temperatura entre los 600 Cº y los 650 Cº, durante treinta minutos en una atmósfera pobre en oxigeno, a fin de eliminar las materias orgánicas contaminantes sin producir una combustión. Cementación de oro con Zinc También llamado Método Merril – Crowe, es otro de los métodos de recuperación usados, el proceso que se realiza es el siguiente: 1. A la solución enriquecida en oro que proviene de la percolación en las pilas de lixiviación, se la filtra 2. A esta solución se le extrae él oxigeno disuelto, mediante una columna de desoxigenación, (vacío). 3. A esta solución filtrada y desoxigenada se la pone en contacto con el polvo de zinc. 4. Por un proceso redox, el Zn pasa a la solución oxidándose, entregando electrones que son captados por los átomos de oro que se encuentran en estado de cation con una carga positiva (Au+), el que se reduce sobre la partícula de Zn. 5. Se recupera mediante filtrado todas las partículas de Zn, las que tienen el oro depositado en su superficie. A este se lo llama precipitado de Zn. 6. Luego se lo funde y se obtiene un bullion, lo que no es otra cosa que una aleación de Oro, Plata, Cobre y Zinc. 7. A este bullion se lo pasa a una etapa de refinación para obtener el oro 24 kilates, que es oro sellado. Retomando el tema anterior de la lixiviación por percolación vemos que se deberá tener en cuenta ciertos aspectos: Preparación del piso de la pila La cianuración en pilas se realiza con un material depositado sobre un piso o base impermeable donde se colectan las soluciones enriquecidas para evitar perdidas de oro y plata, como así también posibles contaminaciones de la napa freática en el caso de perdidas de soluciones cianuradas en el terreno. Se utilizan materiales, para su construcción, como por ejemplo asfalto, hormigón, capas plásticas y ripio compactado con arcillas. Preparación del mineral Los minerales poco permeables a las soluciones deben ser triturados para mejorar la exposición al ataque químico de las soluciones. El grado óptimo de trituración se determina con la realización de ensayos de lixiviación en columnas a escala laboratorio. Estas pruebas también revelan la cantidad de cal que se le debe agregar para neutralizar los componentes ácidos de las menas, evitando de esa manera la destrucción de CNNa por hidrólisis por ende la generación de ácido cianhídrico, el cual es altamente venenoso. Construcción de la pila El armado de la pila es un punto crítico en la operación, la que requiere cuidados para obtener un lecho poroso y permeable donde las partículas se presenten uniformemente distribuidas y que no exista segregación de tamaños. Unas de las técnicas usadas consisten en depositar el mineral por capas, según el ángulo natural de reposo, siendo para tal efecto vaciado en el borde superior de la pila con el objeto de hacerlo rodar en cascada por la pendiente. Aplicación de la solución La técnica mas difundida es la de esparcir la solución mediante procesos de goteo o rocío con tuberías plásticas perforadas. La decisión a favor de la lixiviación en pila solo puede tomarse luego de un análisis basado en el comportamiento metalúrgico de la mena estudiada. Se evaluaran las siguientes relaciones: 1. Grado de trituración ves. Percolabilidad 2. Consumo de reactivo vs. Recuperación de oro 3. Consumo de reactivos vs. Concentración de reactivos
Suscribirse a:
Entradas (Atom)